surveillance après commercialisation
14 résultats affichésTrié du plus récent au plus ancien
-
IVDR-RDMDIV : Traçabilité
150,00€ -
IVDR-RDMDIV : Vigilance et surveillance après commercialisation
200,00€ -
MDR-RDM : Données cliniques
250,00€ -
MDR-RDM : Exigences Générales en matière de Sécurité et de Performances
200,00€ -
MDR-RDM : Retraitement des DM à usage unique
150,00€ -
MDR-RDM : Vigilance et surveillance après commercialisation
200,00€ -
MDR-RDM : Traçabilité
150,00€ -
MDR-RDM : Opérateurs Économiques
200,00€ -
MDR-RDM : Généralités sur les nouveaux règlements remplaçant les directives sur les DM
200,00€ -
Évaluation clinique des dispositifs médicaux
800,00€ -
Connaître et appliquer la gestion des risques pour les dispositifs médicaux avec l’ISO 14971:2019
850,00€ -
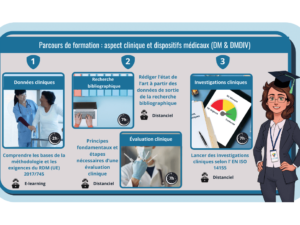
Parcours : aspect clinique et dispositifs médicaux
1 850,00€ -
Investigations cliniques des DM : ISO 14155, règlement européen et Bonnes Pratiques Cliniques
800,00€ -
Formation – Action : étude des cas de votre organisation et de vos produits : RDM (UE) 2017/745